Zellbiologie der RNA-Viren
Leitung: Dr. Gabrielle Vieyres
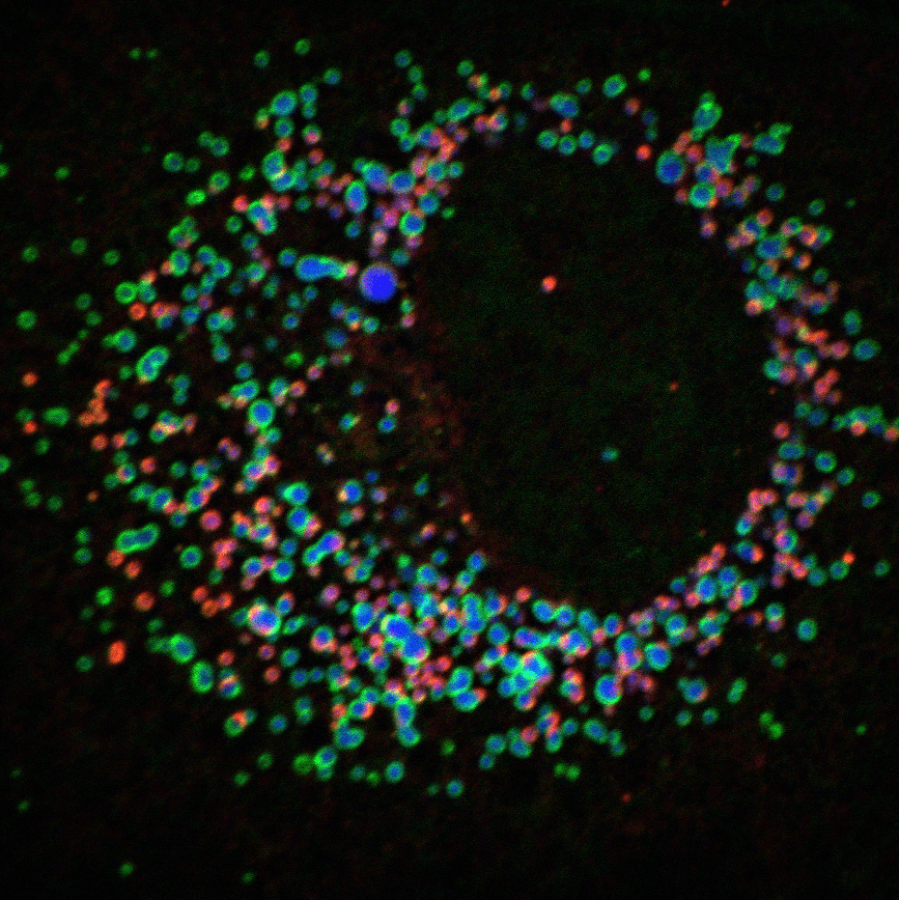
Lipidtröpfchen bei Virusinfektionen
Als obligate intrazelluläre Pathogene mit begrenzter Genomgröße haben RNA-Viren die Fähigkeit erlangt, der Wirtszelle Ressourcen zu entziehen und gleichzeitig ihre Abwehrkräfte zu überlisten. Einige der angewandten Strategien sind unter Pathogenen weitgehend konserviert. Zum Beispiel verändern Plus-Strang-RNA-Viren die Membranen der Wirtszelle, um eine Replikationsorganelle zu bilden. Dieses Kompartiment konzentriert virale und usurpierte zelluläre Replikationsfaktoren und isoliert die virale Replikationsmaschinerie von der angeborenen Immunabwehr. Zusätzlich zur Induktion neuer spezialisierter Kompartimente nutzen die Viren auch bestehende Kompartimente der Wirtszelle aus. Dies ist der Fall des endocytischen Kompartiments, das bereits vor über 40 Jahren mit dem Eindringen zahlreicher Viren assoziiert wurde. In jüngerer Zeit haben sich Lipidtröpfchen als Schlüsselorganelle für die Replikation eines Spektrums von Krankheitserregern, darunter Viren, Bakterien und Parasiten, herauskristallisiert. In vielen Fällen sind jedoch ihre genaue Rolle im Replikationszyklus des Erregers und die Maschinerie, die der Erreger benutzt, um diese Organelle zu entführen, nur unzureichend verstanden. Lipidtröpfchen sind das Hauptenergiereservoir der Zelle, aber auch die Quelle für Struktur- und Signallipide, alles begehrte Ressourcen für Krankheitserreger. Angesichts dieser Rolle als Stoffwechselknotenpunkt ist es wahrscheinlich, dass ihre Rolle bei der Infektion mit Krankheitserregern noch immer unterschätzt wird.
Innerhalb des InterACt-Netzwerks und am Heinrich-Pette-Institut angesiedelt, untersucht die Nachwuchsgruppe "Zellbiologie der RNA-Viren" die raum-zeitliche Dynamik viraler Replikationskompartimente mit Schwerpunkt auf RNA-Viren und Lipidtröpfchen. Das Hepatitis-C-Virus (HCV) ist ein besonders interessantes Modell für diese Erreger-Wirt-Interaktion, da seine Morphogenese von den Lipidtröpfchen des Wirts abhängt und seine Pathogenese, insbesondere die HCV-induzierte nichtalkoholische Fettleberkrankheit (NAFLD), die Modifikation dieses Kompartiments beinhaltet. Wir haben bereits früher berichtet, dass das Hepatitis-C-Virus einen lipolytischen Weg der Wirtshepatozyten kapert, um neutrale Lipide aus den Lipidtröpfchen zu extrahieren und seine eigene Morphogenese zu unterstützen (Vieyres et al., PLoS Pathogens 2016; Vieyres et al., PLoS Pathogens 2020). Wir sind dabei, dieses Zusammenspiel auf der Ebene der einzelnen Lipidtröpfchen weiter zu entwirren und den Effekt einer HCV-Infektion auf dieses Kompartiment zu überwachen. In dieser Hinsicht glauben wir, dass die HCV-Forschung auch einen wertvollen Einblick in die Funktionen und Fehlfunktionen dieser Organelle geben kann, die bei den aktuellen Epidemien von Fettlebererkrankungen eine zentrale Rolle spielen. Unterstützt durch das Kompetenzspektrum des InterACt Science Campus und in Synergie mit der Forschungsgruppe von Prof. Eva Herker an der Universität Marburg nutzen wir unsere Expertise in molekularer Virologie und Zellbiologie, kombiniert mit hochauflösender Fluoreszenzmikroskopie, Live-Cell-Imaging, Bildanalysemethoden und Data Mining, um neue Interaktionen zwischen RNA-Viren und dieser Organelle, ihre Funktion bei der Virusreplikation und Pathogenese aufzuzeigen. Langfristig könnte die Ausrichtung antiviraler Verbindungen auf dieses zentrale Zellkompartiment oder das "Schließen des Hahns", der die Virusreplikation antreibt, neue Perspektiven für anti-infektiöse Therapien eröffnen.